ENFERMERÍA CUIDÁNDOTE - ISSN 2695-9364
González García R. Microbiota y Endometriosis: ¿existe relación? Una revisión de la literatura
Microbiota y Endometriosis: ¿existe relación? Una revisión de la literatura
Microbiota and Endometriosis: is there a relathionship? A review of the literature
Autora:
Autora de correspondencia:- Rocío González García
 . Hospital Materno Infantil. Málaga. España.
. Hospital Materno Infantil. Málaga. España.
Correo electrónico: rociogonzalez281199@gmail.com
- 19/01/2025
- 24/02/2025
- González García R. Microbiota and Endometriosis: is there a relathionship? A review of the literature. Enferm Cuid. 2025;8. https://doi.org/10.51326/ec.8.1519194
 Las obras se publican en esta revista bajo una licencia Creative Commons Attribution 4.0 International License (CC BY 4.0) que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
Las obras se publican en esta revista bajo una licencia Creative Commons Attribution 4.0 International License (CC BY 4.0) que permite a terceros utilizar lo publicado siempre que mencionen la autoría del trabajo y a la primera publicación en esta revista.
|
Resumen Introducción: La endometriosis es una enfermedad caracterizada por el crecimiento de tejido endometrial fuera del útero que causa dolor pélvico, infertilidad e inflamación. La microbiota, especialmente la intestinal y vaginal, tiene un papel crucial en la regulación hormonal e inmunitaria, pudiendo contribuir a la patogénesis de la endometriosis. Objetivos: Analizar la relación entre la microbiota intestinal y del aparato reproductor femenino y la endometriosis, e investigar los cambios en la microbiota vaginal, uterina e intestinal presentes en mujeres con esta enfermedad. Metodología: Se realizó una búsqueda exhaustiva en bases de datos científicas utilizando términos DeCS/MeSH. Los artículos seleccionados fueron en español o inglés y publicados entre 2014 y 2024. Tras evaluar su calidad científica, se analizaron 30 artículos relevantes. Resultados: La revisión muestra alteraciones significativas en la microbiota vaginal, uterina e intestinal de mujeres con endometriosis, destacándose disbiosis caracterizada por la disminución de bacterias beneficiosas y el aumento de patógenos. Estas alteraciones se asocian con inflamación crónica, alteraciones en la metabolización de estrógenos y la progresión de la enfermedad. Discusión: El análisis de la microbiota podría ser útil como herramienta diagnóstica no invasiva. Se propone el uso de Lactobacillus, probióticos vaginales y antibióticos específicos como tratamiento. Conclusiones: La microbiota juega un papel relevante en el desarrollo de la endometriosis. Es necesario continuar la investigación y fomentar el apoyo en salud pública para mejorar el diagnóstico y tratamiento de la enfermedad, lo que contribuiría a mejorar la calidad de vida de las mujeres afectadas. Palabras clave: Endometriosis; Microbiota; Útero; Vagina. |
|
Abstract Introduction: Endometriosis is a disease characterized by the growth of endometrial tissue outside the uterus, causing pelvic pain, infertility, and inflammation. The microbiota, especially the intestinal and vaginal microbiota, plays a crucial role in hormonal and immune regulation, and may contribute to the pathogenesis of endometriosis. Objectives: To analyze the relationship between the intestinal microbiota and the female reproductive system and endometriosis, and to investigate the changes in the vaginal, uterine, and intestinal microbiota present in women with this disease. Methodology: An exhaustive search was carried out in scientific databases using DeCS/MeSH terms. The selected articles were in Spanish or English and published between 2014 and 2024. After evaluating their scientific quality, 30 relevant articles were analyzed. Results: The review shows significant alterations in the vaginal, uterine, and intestinal microbiota of women with endometriosis, highlighting dysbiosis characterized by the decrease of beneficial bacteria and the increase of pathogens. These alterations are associated with chronic inflammation, alterations in estrogen metabolism, and disease progression. Discussion: Microbiota analysis could be useful as a noninvasive diagnostic tool. The use of Lactobacillus, vaginal probiotics, and specific antibiotics is proposed as treatment. Conclusions: Microbiota plays a relevant role in the development of endometriosis. It is necessary to continue research and promote public health support to improve the diagnosis and treatment of the disease, which would contribute to improving the quality of life of affected women. Keywords: Endometriosis; Microbiota; Uterus; Vagina. |
|
Introducción La endometriosis es una enfermedad del aparato reproductor femenino en la que el tejido endometrial surge y crece fuera del útero, pudiendo colonizar ovarios, trompas de Falopio y, en estadios más graves, intestinos y vejiga1,2. La enfermedad está presente entre el 10 y el 15% de las mujeres en edad reproductiva, con mayor incidencia entre los 30 y 45 años, siendo inusual su presentación previa a la menarquia o posterior a la menopausia. En Andalucía, se registran alrededor de 1.500 hospitalizaciones anuales por endometriosis, siendo la más frecuente la endometriosis en ovario (60-65%), seguida de la uterina (18-20%) y, en menor medida, las lesiones endometriales que se encuentran en peritoneo y pelvis. La razón de fecundidad es del 0,02-0,10 por mes, mientras que en mujeres sanas es del 0.15-0.20 por mes3. La Sociedad Americana de Fertilidad y la Sociedad Americana de Medicina Reproductiva establecieron una clasificación de la enfermedad en función de la localización, diámetro y densidad de lesiones. La enfermedad se clasifica en cuatro etapas o estadios.
El riesgo de desarrollar endometriosis está relacionado con una mayor exposición a la menstruación, por ejemplo; aparición temprana de la menarquia, ciclos menstruales más cortos, períodos menstruales más prolongados, mayor duración del sangrado, tener menos embarazos y reducción del tiempo de lactancia materna4. La patogenia de la endometriosis está relacionada con factores ambientales, genéticos, desregulación inmunológica y hormonal. Se han propuesto diversas teorías sobre su etiología, pero la más sólida, pese a seguir siendo debatida, es la teoría de la “menstruación retrógrada”, que consiste en que fragmentos endometriales migran a la cavidad peritoneal a través de las trompas de Falopio durante la menstruación. Aun así, la patogénesis de la endometriosis sigue siendo difícil de explicar, incluso después de 300 años de investigación2,5-11. Es una enfermedad dependiente de hormonas, ya que lo síntomas se manifiestan durante la etapa fértil de la mujer y responden a tratamientos hormonales. El estrógeno juega un papel crucial, estimulando la proliferación de tejido endometrial fuera del útero y la inflamación del mismo1. Al igual que el tejido endometrial normal, estas lesiones responden a los estrógenos, lo que las hace proliferar y sangrar durante el ciclo menstrual. Esto causa inflamación, dolor pélvico crónico, dismenorrea, dispareunia, disuria e infertilidad. Estos síntomas, generalmente crónicos, pueden afectar el bienestar físico, mental, sexual y social de la mujer1,2,11,12. El diagnóstico es complicado dada la alta heterogeneidad en la clínica de la endometriosis, está centrado en ecografía, pero generalmente se confirma mediante exploración quirúrgica9,10,13. El tratamiento es diverso y gira en torno a la cirugía y a la terapia hormonal, donde se suprime el eje hipotálamo-hipófisis-ovario, reduciendo los niveles de estrógenos, induciendo a la amenorrea y reduciendo la progresión de la enfermedad1,2,14. Las altas tasas de recurrencia después de la cirugía y los efectos secundarios de la medicación complican aún más el tratamiento de esta enfermedad. Por lo tanto, se necesita urgentemente más investigación para explorar la patogenia de la endometriosis y proporcionar una base teórica y una guía para las estrategias de tratamiento clínico5. La microbiota humana comprende todos los microorganismos (bacterias, arqueas, protistas, hongos y virus) que crecen y proliferan tanto en el interior como en el exterior del cuerpo humano. Su impacto es crucial en nuestra salud y bienestar, sus funciones albergan tanto funciones metabólicas e inmunitarias. La etnia, edad, dieta, estrés y exposición a sustancias químicas pueden influir su composición. Un término relacionado es el de microbioma, que consiste en el conjunto de genes y metabolitos que componen los microorganismos de la microbiota1,8,15,16. La disbiosis es el desequilibrio de la microbiota, causado por un aumento de microbios patógenos o pérdida de probióticos. Sus consecuencias pueden ser notables para la salud humana y está asociada con muchas enfermedades como la enfermedad intestinal inflamatoria, psoriasis, artritis y cáncer. Las investigaciones recientes están planteando la posibilidad de que la disbiosis pueda estar involucrada en la alteración del metabolismo de los estrógenos1,4,8,17. El microbioma intestinal humano, a menudo denominado el "segundo genoma humano", abarca aproximadamente entre 1013 y 1014 microorganismos, principalmente del género Bacteroidetes, Firmicutes, Actinobacteria y Proteobacteria. Cambios en la microbiota intestinal pueden influir en la permeabilidad intestinal, digestión, metabolismo y respuestas inmunitarias. Esta microbiota cumple diversas funciones dentro del organismo, entre ellas la absorción de nutrientes, protección y regulación inmunitaria. Además, afecta en la regulación de los niveles de estrógenos, un desequilibrio en sus niveles puede contribuir a trastornos, como la endometritis o infertilidad. La disbiosis intestinal puede estar relacionada con la patogénesis de la endometriosis, ya que hasta el 90% de las pacientes con endometriosis presentan síntomas gastrointestinales como: distensión abdominal, náuseas, estreñimiento, diarrea y vómitos1,2,5,8,17. La disbiosis intestinal puede alterar la función inmunitaria y la barrera epitelial, incrementando la inflamación local y sistémica, la cual está vinculada a trastornos como el síndrome del intestino irritable (SII), cáncer, Síndrome de ovario poliquístico (SOP) y endometriosis. Además, el SII es común en mujeres con endometriosis, sugiriendo una posible conexión entre estas afecciones debido a la inflamación sistémica y la alteración de la barrera epitelial2,12,18-20. El estroboloma es el conjunto de genes de la microbiota intestinal involucrados en el metabolismo del estrógeno. Estos genes tienen la capacidad de influir en la gravedad de los trastornos relacionados con los estrógenos mediante la desregulación de la actividad de enzimas como la β-glucuronidasa, asociadas con cánceres dependientes de estrógenos. Además, el estrógeno afecta la fertilidad al modificar la calidad del endometrio, lo que puede interferir con la implantación del embrión2,9,16-19. Durante décadas se ha considerado al tracto reproductor femenino superior como un entorno estéril; gracias a las investigaciones recientes, se ha demostrado lo contrario. El microbioma del aparato reproductor femenino comprende el 9% del total de bacterias de la mujer, su composición varía entre sus diferentes partes y puede verse influenciada por la edad (Imagen 1), etnia, actividad sexual, estado de salud, momento del ciclo menstrual, entorno y alimentación1,15,18,21. La microbiota vaginal saludable se define principalmente por la presencia de bacterias del género Lactobacillus. Las células epiteliales vaginales acumulan glucógeno que puede ser metabolizado por estas bacterias, disminuyendo el pH vaginal, protegiendo a la mujer de colonizaciones de bacterias patógenas como Chlamydia trachomatis, Neisseria gonorrhoeae y Trichomonas vaginalis. Un cambio en la composición de la microbiota vaginal puede asociarse con mayor riesgo de presentar endometritis, endometriosis, enfermedad pélvica inflamatoria (EPI) e infertilidad15,16. Su composición varía a lo largo de la vida de la mujer gracias a los cambios hormonales. Durante la infancia, el pH es neutro, predominando los microorganismos anaerobios y Escherichia Coli. Durante la edad fértil, el estrógeno favorece el predominio de Lactobacillus spp. Por último, en la menopausia la disminución de estrógenos reduce los Lactobacillus, aumentando los niveles de Anaerococcus, Peptoniphilus, Gardenerella y Prevotella1,2,17,22. La disbiosis vaginal produce cambios significativos, aumentando el riesgo de contraer, Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis y el virus de la inmunodeficiencia humana (VIH)23. Durante el embarazo, el microbioma vaginal se caracteriza por un dominio de Lactobacillus spp., una disminución en sus niveles podría estar relacionados con los partos pretérmino22. La microbiota uterina de mujeres sanas está poblada por Firmicutes, Bacteroidetes, Prevotella spp., Proteobacteria y Actinobacteria1,21. La microbiota endometrial está caracterizada por Lactobacillus spp., Lactobacillus iners, Mycoplasma hominis, Bifidobacterium, Prevotella, Atopobium, Gardnerella vaginalis y Enterobacter spp. Se plantea la posibilidad de que las bacterias colonizan el endometrio mediante un ascenso desde la vagina o a través del semen1,16,18,21,22. La microbiota vaginal y endometrial varía a lo largo del ciclo menstrual, influenciada sobre todo por los cambios de los estrógenos. Mientras algunos estudios muestran alta estabilidad de Lactobacillus spp., otros reportan fluctuaciones en bacterias como Cutibacterium acnes, Prevotella y Sneathia en distintas fases22. En la microbiota de las trompas de Falopio y ovarios, existe una mayor variabilidad entre mujeres, pero se suelen encontrar bacterias del género Bacteroides, Corynebacterium, Lactobacillus, Coprococcus e Hymenobacter en las trompas de Falopio, y Lactobacillus, Prevotella, Corynebacterium, Escherichia y Blautia en el ovario. Es importante destacar que la cantidad de bacterias Lactobacillus es menor que en vagina16,22. El microbioma cervical está compuesto por Lactobacillus, Prevotella, Gardnerella y Fusobacterium22. La evidencia sugiere que existe un papel activo entre las infecciones microbianas subclínicas en el aparato reproductor femenino y el desarrollo y progresión de la endometriosis23. Objetivos Como objetivo principal de la presente revisión de la literatura, se propuso analizar si existe relación entre la microbiota intestinal y del aparato reproductor femenino, y la endometriosis. Como objetivo secundario se determinó analizar los cambios en la microbiota vaginal, uterina e intestinal en la endometriosis. Metodología Se ha llevado a cabo una revisión de la literatura científica disponible realizada, con el objetivo tanto de conocer si existe relación entre la microbiota intestinal y del aparato reproductor femenino y la endometriosis, como de analizar los cambios existentes en la microbiota de las mujeres que padecen dicha enfermedad. Para ello, ha sido necesario el uso de descriptores y operadores booleanos introducidos en diferentes bases de datos. Previamente a la realización de la búsqueda, se realizó la selección de las palabras clave mediante las cuales se ha podido desarrollar la revisión. Para ello, se han usado los Descriptores en Ciencias de la Salud (DeCS) y Medical Subject Headings MeSH. Asimismo, se han empleado bases de datos de diferentes fuentes bibliográficas de Ciencias de la Salud como Pubmed, Biblioteca Cochrane, TRIPdatabase y Epistemonikos. Se realizó una búsqueda manual para amplificar la información sobre epidemiología y clasificación de los diferentes estadios de la endometriosis. Los criterios de inclusión elegidos fueron:
Las palabras clave utilizadas fueron: Endometriosis, Microbiota, Uterus y Vagina. Se ha requerido el siguiente operador booleano para conducir la búsqueda a los objetivos a estudiar: AND. En total, se obtuvieron 82 artículos, los cuales fueron reducidos a 70 tras eliminar los duplicados. Los restantes fueron analizados por título y resumen; de ellos, se desecharon 27 por no adecuarse al tema y objetivos y por ser entradas a blogs, 5 de los artículos se desecharon por no tener resultados publicados. Los 38 restantes fueron analizados según su calidad científica, siguiendo la herramienta CONSORT para revisar ECAS, y PRISMA para analizar las revisiones sistemáticas de la bibliografía; de los cuales se eliminaron 8. En total, fueron 30 los artículos analizados para la presente revisión de la literatura. Resultados La revisión realizada de la literatura disponible ha identificado alteraciones significativas en la microbiota de la mujer con endometriosis respecto a mujeres sanas. A continuación, se exponen los principales resultados obtenidos: Relación entre disbiosis e inflamación La inflamación crónica asociada a esta enfermedad parece estar ligada a la disbiosis en el tracto genital inferior e intestino. Las bacterias gramnegativas (como E. Coli) pueden liberar toxinas bacterianas como los lipopolisacáridos (LPS), activando receptores del tipo Toll 4 (TLR-4) en células inmunes, lo que desencadena una cascada inflamatoria caracterizada por la producción de citocinas proinflamatorias como TNF-α e IL-6. Las hormonas también pueden alterar el ciclo inflamatorio1,11,15,18,20,24. En el caso del tracto genital, la inflamación localizada promueve la colonización de las bacterias patógenas, generando un ambiente adverso para las bacterias beneficiosas. En útero y cérvix, la disbiosis está asociada con un aumento de los patógenos Escherichia coli y Gardnerella vaginalis, Streptococcus y Pseudomonas, disminuyendo los niveles de Lactobacillus spp., contribuyendo al estado inflamatorio. Según Jiang, las pacientes con enfermedad pélvica inflamatoria tienen tres veces más riesgo de desarrollar endometriosis, lo cual refuerza la hipótesis de relación entre inflamación, disbiosis y endometriosis1,4,8,11,12,15,22,24,25. Varios de los estudios analizados declaran que también se observa disbiosis en el líquido peritoneal de las mujeres con endometriosis, el cual presenta un aumento de bacterias que promueven la inflamación. Específicamente, en el líquido peritoneal se encontraron bacterias de la familia Escherichia coli, Comamonas, además de Estreptococos, Estafilococos y Ureaplasma, que no se encontraron en las muestras estudiadas de mujeres sanas, revelando así que la disbiosis no solo se limita a los órganos reproductivos e intestino, sino que afecta a tejidos circundantes2,4,7,11,13,23. Microbiota vaginal y cervical Las mujeres con endometriosis presentan una alteración de la microbiota en el tracto genital inferior, caracterizado por una reducción significativa de las bacterias del género Lactobacillus spp. Esto genera un entorno que favorece el crecimiento de patógenos, lo cual está relacionado con inflamación crónica y elevación del pH vaginal, pudiendo ser tanto un factor contribuyente como un resultado de la enfermedad propia en sí1,2,8,11,13,15,18. Dos de los treinta estudios analizados declaran la ausencia de bacterias del género Atopobium en mujeres con endometriosis en estadio III y IV, microorganismo relacionado con la salud ginecológica. Otros estudios demuestran que las muestras tomadas en mujeres con endometriosis presentan bacterias patógenas como Gardnerella, Streptococcus, Escherichia, Shigella, Enterobacteriaceae y Ureaplasma1,2,6,8,11,17,23. El estudio liderado por Sessa revela que las muestras vaginales de mujeres con endometriosis difieren de las mujeres sanas en cuanto a diversidad microbiótica, desvelando que en mujeres afectadas existe una disminución significativa de microorganismos beneficiosos, como Bifidobacterium, Novispirillum y Sphingomonas. Por el contrario, se observa un aumento significativo de géneros como Escherichia, Megasphaera y Sneathia, en comparación con mujeres sin patología. Este estudio también revela que las mujeres con endometriosis que no están tratadas con terapia hormonal tienen un incremento de bacterias del género Gardnerella, Prevotella y Sneathia, mientras que las mujeres estudiadas con tratamiento hormonal no presentan esa elevación de estas familias de bacterias14. El estudio de García-Peñarrubia revela que la dispareunia (uno de los síntomas principales de la endometriosis) está relacionada con la presencia de Ureaplasma parvum en muestras tomadas en cérvix y vagina23. Microbiota uterina y endometrial La microbiota que alberga el útero de pacientes con endometriosis presenta diferentes características en comparación con los úteros estudiados libres de enfermedad. Varios de los artículos analizados observan mayor diversidad microbiana centrada en bacterias gramnegativas, junto a un descenso de bacterias del género Lactobacillus spp. y un aumento de bacterias relacionadas con la Vaginosis Bacteriana, Atopobium, Prevotella spp., Porphyromonas spp. y Gardnerella vaginalis. También existe un aumento de bacterias del género Proteobacteria spp., Firmicutes spp. y Actinobacteria spp., según Sobstyl13,17,18.21,22,26,27. La abundancia de bacterias gramnegativas fomenta un ambiente que fomenta la inflamación, lo cual no solo favorece a la implantación de tejido endometrial ectópico, sino que también afecta al ciclo infamatorio que define a la enfermedad1,18. En cuanto a las características de la microbiota endometrial, dos artículos documentan la presencia de Escherichia coli y Fusobacterium, cuyo rol reside en la inflamación sistémica y formación de tejido endometrial ectópico. Esto sugiere que la infección bacteriana pudiera ser un factor contribuyente a la enfermedad13,23. Uno de los treinta estudios analizados ha investigado sobre la microbiota de las propias lesiones endometriales ectópicas, demostrando que tienen un mayor crecimiento de bacterias del género Alishewanella, Enterococcus y Pseudomonas, junto con la reducción de Lactobacillus2. Dos artículos revelan que la microbiota uterina puede afectar al correcto metabolismo de los estrógenos, fomentando el avance de las lesiones propias de la enfermedad. Según Jiang, las mujeres con endometriosis presentan un aumento de ciertas bacterias que favorecen la acción de la enzima β-glucuronidasa, que incrementa los niveles de estrógenos, estimulando la proliferación de tejido endometrial fuera del útero1,5. Microbiota intestinal La microbiota intestinal también presenta alteraciones significativas en mujeres con endometriosis, lo cual sugiere una relación entre el intestino y la etiología de la enfermedad. Tres estudios de los treinta estudiados documentan un cambio en la proporción de bacterias Firmicutes/Bacteroidetes, con un predominio de bacterias influyentes en la inflamación como la Escherichia coli y Shigella spp. en mujeres con endometriosis. Estas bacterias pueden contribuir a la inflamación crónica y sistemática del cuerpo de la mujer al salir del medio intestinal a través de una barrera intestinal debilitada1,2,4,5,8,17. La microbiota intestinal también regula los niveles de estrógeno a través de la acción de la enzima β-glucuronidasa, la cual es producida por ciertas bacterias intestinales. La actividad de esta enzima se encuentra aumentada en medios caracterizados por la disbiosis, incrementando los niveles de estrógeno activo, exacerbando la progresión y síntomas de la enfermedad, además de potenciar las condiciones que facilitan infecciones genitales como la vaginosis bacteriana, favoreciendo la endometritis y endometriosis. Además, el estudio de Qi declara que un exceso de bacterias que aumenten los niveles de estrógenos podría estar relacionado con cánceres estrógeno dependientes como el cáncer de mama, endometriosis y otras enfermedades metabólicas. Por otro lado, el estudio de Wang revela que una disminución del nivel de estrógenos contribuiría a condiciones como el SOP1,2,4,5,11,16,19,20. Varios estudios basados en investigaciones con animales, demuestran una relación existente entre la endometriosis y la microbiota intestinal. Por ejemplo, los artículos que han analizado a ratones observaron que después de 42 días de persistencia de tejido endometrial fuera del útero, la microbiota intestinal de estos mamíferos cambió, destacando una proporción casi duplicada de bacterias Firmicutes/Bacteroidetes, lo cual indica disbiosis. Este desequilibrio también ha sido documentado por Jiang al estudiar la microbiota intestinal de los macacos Rhesus1,4,16,20. En ratones también se ha analizado como al introducir materia fecal de ratones con endometriosis a ratones libres de enfermedad, se promueve la creación de lesiones endometriales ectópicas y aumento de la inflamación sistémica, lo que sugiere que la disbiosis intestinal puede ser un factor contribuyente de la endometriosis1,4,10,11,28. Tres de los estudios analizados demuestran los efectos de la antibioterapia en ratones con endometriosis. La investigación de Chadchan y Kobayashi muestran que los ratones tratados con antibióticos de amplio espectro, que redujeron significativamente la microbiota intestinal, presentaron un crecimiento menor de las lesiones provocadas por la enfermedad en comparación con el grupo de ratones control. Por otro lado, el análisis de Uzuner revela que el uso de metronidazol en ratones redujo considerablemente el tamaño de las lesiones endometriósicas. Esto sugiere que la microbiota intestinal favorece la progresión de la enfermedad4,10,11. Según Jiang, la microbiota intestinal puede influir en la homeostasis de las células madre, afectando a su migración y al crecimiento ectópico del tejido endometrial1. Tratamiento, ciclo menstrual y estilo de vida El uso del tratamiento hormonal parece estabilizar la microbiota vaginal y uterina en pacientes con endometriosis, aunque no equilibra totalmente la flora bacteriana. Según el estudio de Svensson, las mujeres en tratamiento hormonal mostraron mayor presencia de bacterias del tipo Blautia, Ruminococcus y Butyricimonas en las muestras tomadas para analizar la microbiota intestinal14,25. Tres de los estudios analizados mostraron que el uso de antibióticos específicos puede alterar significativamente la composición de la microbiota del tracto reproductivo femenino, reduciendo la inflamación y la progresión de las lesiones endometriales. Ello respalda la hipótesis de que la microbiota ejerce un papel clave en el desarrollo de la enfermedad6,27-29. El estilo de vida de las pacientes (número de parejas sexuales, consumo de tóxicos, alimentación, etc.) también puede influir en el microbioma de la mujer y, por consiguiente, en el desarrollo de la enfermedad. Uno de los estudios analizados declara que las mujeres con mayor número de parejas sexuales muestran una microbiota más alterada30. Por otro lado, uno de los artículos estudió la relación entre la Vitamina D y su efecto en la microbiota y relación con la endometriosis. La vitamina D actúa en la homeostasis del microbioma intestinal, sus receptores se encuentran en intestino, útero e hígado. Su deficiencia ha sido asociada con disbiosis y su suplementación aumentó la diversidad general de la microbiota intestinal16. Según Jiang, las dietas ricas en ácidos grasos omega-3 mostraron efectos antiinflamatorios y redujeron las lesiones endometriales, lo que podría estar relacionado con la capacidad de estas dietas para restaurar el equilibrio microbiano y reducir la inflamación crónica1. El ciclo menstrual, caracterizado por fluctuaciones hormonales, afecta tanto a la microbiota como a las células inmunes del endometrio, influyendo en los niveles de linfocitos, macrófagos y neutrófilos. Por ejemplo, en la fase secretora del ciclo, los niveles de macrófagos aumentan6,21. Discusión La relación existente entre la microbiota del aparato reproductor femenino e intestinal y la endometriosis, comprende un campo de investigación emergente que destaca la interacción compleja y bidireccional entre ambas. La alteración entre la microbiota vaginal y cervical parece ser un fenómeno que se repite entre las mujeres afectadas por la endometriosis. La reducción de bacterias beneficiosas, como los Lactobacillus, y el aumento de bacterias patógenas es un hallazgo documentado en varios artículos analizados, lo que favorece un entorno perjudicial centrado en la inflamación y en la infección. Ello contribuye a la migración de bacterias al tracto reproductor superior y peritoneo, fomentando la progresión de la endometriosis2,6,13,15,16,18,22. Teniendo estas premisas en cuenta y sabiendo la dificultad del diagnóstico de esta enfermedad, podríamos usar esta información en beneficio tanto del profesional sanitario como de la población afectada. De manera que utilizaríamos la microbiología como método complementario y no invasivo al diagnóstico, pudiendo analizar la microbiota tanto vaginal y cervical como intestinal de las mujeres cuya clínica sugiera esta enfermedad, para poder confirmarla o, incluso, diagnosticarla en etapas tempranas de la misma13. A su vez, sería beneficioso en cuanto a gestión sanitaria, ya que el costo-beneficio del uso del análisis de muestras vaginales sería muchísimo menor comparándolo con el costo que requieren las exploraciones quirúrgicas que se precisan para el diagnóstico de la enfermedad. En cuanto a tratamiento, ya hemos analizado los resultados de varios artículos donde suministrando antibióticos, se pueden remitir ciertos síntomas de la enfermedad como la inflamación o el crecimiento de lesiones. Pero se podría proponer una nueva línea de tratamiento, pensada sobre todo para mujeres en estadios tempranos de la enfermedad empleando Lactobacillus spp. junto a probióticos a nivel vaginal para poder restaurar la microbiota beneficiosa, disminuir el pH de la zona y así evitar la colonización de bacterias patógenas que crean un ambiente proinflamatorio, mejorando incluso los resultados reproductivos de las pacientes1,6,10-12,18,19,27-29. A pesar de los resultados tan prometedores, persisten dudas sobre si las alteraciones en la microbiota son una causa o una consecuencia de la enfermedad. Un ejemplo sería que la inflamación propia de la enfermedad propiciaría un entorno mediado por la disbiosis. Sin embargo, por otro lado, la microbiota alterada que genera un entorno proinflamatorio sería el vector que facilite el inicio de la enfermedad. Por ello, la evidencia sugiere seguir investigando11. Faltan estudios longitudinales que certifiquen una relación causal clara entre la microbiota y la endometriosis. Aunque los resultados sean prometedores, algunos artículos plantean la posibilidad de contaminación en la conservación y análisis de las muestras durante la recolección de las mismas, lo que plantearía un desafío a la hora de realizar nuevas investigaciones. Limitaciones del estudio y futuras líneas de investigación Como limitaciones al estudio, se ha encontrado que la mayoría de estudios tienen un tamaño muestral limitado y presentan heterogeneidad en los términos de diseño y metodología. Como nuevas líneas de investigación, se propone realizar estudios longitudinales que estudien la evolución de la microbiota en la enfermedad, además de seguir investigando cómo los factores socioeconómicos, culturales, ambientales y estilos de vida afectan a la microbiota, tanto del aparato reproductor como intestinal, y su relación con la endometriosis. Conclusiones El análisis entre la microbiota y la endometriosis, revela que la microbiota no solo del aparato reproductor de la mujer, sino de órganos adyacentes como el intestino, es un componente de gran valor en el desarrollo de la enfermedad, afectando a la clínica de las pacientes. No obstante, la evidencia no certifica si la disbiosis es una causa o consecuencia de la enfermedad. Se propone usar la microbiota como método no invasivo para el diagnóstico de la enfermedad y el uso de probióticos y antibióticos específicos para ralentizar la evolución de la endometriosis, revertirla o mejorar los síntomas de la misma. Se necesitan aún más investigaciones con metodologías que analicen de forma longitudinal el desarrollo de la enfermedad, atendiendo al estilo de vida y a factores socioeconómicos y culturales, ya que los artículos analizados plantean diseños y metodologías heterogéneas. Se anima a las políticas de gestión de salud pública a apoyar económicamente la investigación para poder estudiar la microbiota de la mujer, mejorar los resultados en salud, y abaratar costes de diagnósticos y tratamientos, contribuyendo así a mejorar la calidad de vida de las mujeres afectadas. Anexo. Imagen. Imagen 1. Microbiota del tracto reproductor femenino según la etapa del desarrollo de la mujer, ordenado por orden decreciente de predominio. 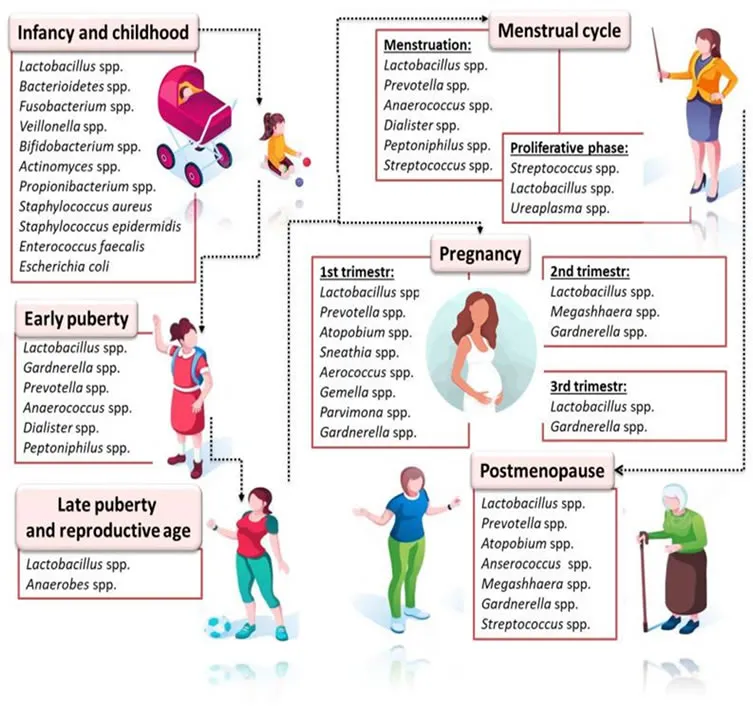 Fuente: Sobstyl A, Chałupnik A, Mertowska P, Grywalska E. How Do Microorganisms Influence the Development of Endometriosis? Participation of Genital, Intestinal and Oral Microbiota in Metabolic Regulation and Immunopathogenesis of Endometriosis. Int J Mol Sci. 2023;24(13):10920. https://doi.org/10.3390/ijms241310920
Bibliografía |
|
1. Jiang I, Yong PJ, Allaire C, Bedaiwy MA. Intricate Connections between the Microbiota and Endometriosis. Int J Mol Sci. 2021;22(11):5644. https://doi.org/10.3390/ijms22115644 2. Salliss ME, Farland LV, Mahnert ND, Herbst-Kralovetz MM. The role of gut and genital microbiota and the estrobolome in endometriosis, infertility and chronic pelvic pain. Hum Reprod Update. 2021;28(1):92-131. https://doi.org/10.1093/humupd/dmab035 3. Servicio Andaluz de Salud. Guía de atención a mujeres con endometriosis en el sistema sanitario público de Andalucía. Sevilla: Servicio Andaluz de Salud; 2017. Disponible en: https://www.sspa.juntadeandalucia.es/servicioandaluzdesalud/sites/default/files/sincfiles/wsas-media-mediafile_sasdocumento/2019/guia_endometriosis_2018.pdf [Consultado 05-02-2025] 4. Kobayashi H. Gut and reproductive tract microbiota: Insights into the pathogenesis of endometriosis (Review). Biomed Rep. 2023;19(1):43. https://doi.org/10.3892/br.2023.1626 5. Tang Y, Yang J, Hang F, Huang H, Jiang L. Unraveling the relationship between gut microbiota and site-specific endometriosis: a Mendelian randomization analysis. Front Microbiol. 2024;15:1363080. https://doi.org/10.3389/fmicb.2024.1363080 6. Doroftei B, Ilie OD, Balmus IM, Ciobica A, Maftei R, Scripcariu I, et al. Molecular and Clinical Insights on the Complex Interaction between Oxidative Stress, Apoptosis, and Endobiota in the Pathogenesis of Endometriosis. Diagnostics (Basel). 2021;11(8):1434. https://doi.org/10.3390/diagnostics11081434 7. Wei W, Zhang X, Tang H, Zeng L, Wu R. Microbiota composition and distribution along the female reproductive tract of women with endometriosis. Ann Clin Microbiol Antimicrob. 2020;19(1):15. https://doi.org/10.1186/s12941-020-00356-0 8. Ata B, Yildiz S, Turkgeldi E, Brocal VP, Dinleyici EC, Moya A, et al. The Endobiota Study: Comparison of Vaginal, Cervical and Gut Microbiota Between Women with Stage 3/4 Endometriosis and Healthy Controls. Sci Rep. 2019;9(1):2204. https://doi.org/10.1038/s41598-019-39700-6 9. Qin R, Tian G, Liu J, Cao L. The gut microbiota and endometriosis: From pathogenesis to diagnosis and treatment. Front Cell Infect Microbiol. 2022;12:1069557. https://doi.org/10.3389/fcimb.2022.1069557 10. Chadchan SB, Naik SK, Popli P, Talwar C, Putluri S, Ambati CR, et al. Gut microbiota and microbiota-derived metabolites promotes endometriosis. Cell Death Discov. 2023;9(1):28. https://doi.org/10.1038/s41420-023-01309-0 11. Uzuner C, Mak J, El-Assaad F, Condous G. The bidirectional relationship between endometriosis and microbiome. Front Endocrinol (Lausanne). 2023;14:1110824. https://doi.org/10.3389/fendo.2023.1110824 12. Xholli A, Cremonini F, Perugi I, Londero AP, Cagnacci A. Gut Microbiota and Endometriosis: Exploring the Relationship and Therapeutic Implications. Pharmaceuticals (Basel). 2023;16(12):1696. https://doi.org/10.3390/ph16121696 13. Qing X, Xie M, Liu P, Feng O, Leng H, Guo H, et al. Correlation between dysbiosis of vaginal microecology and endometriosis: A systematic review and meta-analysis. PLoS One. 2024;19(7):e0306780. https://doi.org/10.1371/journal.pone.0306780 14. Sessa R, Filardo S, Viscardi MF, Brandolino G, Muzii L, Di Pietro M, et al. Characterization of the vaginal microbiota in Italian women with endometriosis: preliminary study. Arch Gynecol Obstet. 2024;310(4):2141-51. https://doi.org/10.1007/s00404-024-07631-x 15. Kaluanga Bwanga P, Tremblay-Lemoine PL, Timmermans M, Ravet S, Munaut C, Nisolle M, Henry L. The Endometrial Microbiota: Challenges and Prospects. Medicina (Kaunas). 2023 Aug 25;59(9):1540. https://doi.org/10.3390/medicina59091540 16. Elkafas H, Walls M, Al-Hendy A, Ismail N. Gut and genital tract microbiomes: Dysbiosis and link to gynecological disorders. Front Cell Infect Microbiol. 2022;12:1059825. https://doi.org/10.3389/fcimb.2022.1059825 17. Colonetti T, Saggioratto MC, Grande AJ, Colonetti L, Junior JCD, Ceretta LB, et al. Gut and Vaginal Microbiota in the Endometriosis: Systematic Review and Meta-Analysis. Biomed Res Int. 2023;2023:2675966. https://doi.org/10.1155/2023/2675966 18. Sobstyl A, Chałupnik A, Mertowska P, Grywalska E. How Do Microorganisms Influence the Development of Endometriosis? Participation of Genital, Intestinal and Oral Microbiota in Metabolic Regulation and Immunopathogenesis of Endometriosis. Int J Mol Sci. 2023;24(13):10920. https://doi.org/10.3390/ijms241310920 19. Qi X, Yun C, Pang Y, Qiao J. The impact of the gut microbiota on the reproductive and metabolic endocrine system. Gut Microbes. 2021;13(1):1-21. https://doi.org/10.1080/19490976.2021.1894070 20. Wang MY, Sang LX, Sun SY. Gut microbiota and female health. World J Gastroenterol. 2024;30(12):1655-62. https://doi.org/10.3748/wjg.v30.i12.1655 21. Agostinis C, Mangogna A, Bossi F, Ricci G, Kishore U, Bulla R. Uterine Immunity and Microbiota: A Shifting Paradigm. Front Immunol. 2019;10:2387. https://doi.org/10.3389/fimmu.2019.02387 22. Punzón-Jiménez P, Labarta E. The impact of the female genital tract microbiome in women health and reproduction: a review. J Assist Reprod Genet. 2021;38(10):2519-41. https://doi.org/10.1007/s10815-021-02247-5 23. García-Peñarrubia P, Ruiz-Alcaraz AJ, Martínez-Esparza M, Marín P, Machado-Linde F. Hypothetical roadmap towards endometriosis: prenatal endocrine-disrupting chemical pollutant exposure, anogenital distance, gut-genital microbiota and subclinical infections. Hum Reprod Update. 2020;26(2):214-46. https://doi.org/10.1093/humupd/dmz044 24. Tai FW, Chang CY, Chiang JH, Lin WC, Wan L. Association of Pelvic Inflammatory Disease with Risk of Endometriosis: A Nationwide Cohort Study Involving 141,460 Individuals. J Clin Med. 2018;7(11):379. https://doi.org/10.3390/jcm7110379 25. Svensson A, Brunkwall L, Roth B, Orho-Melander M, Ohlsson B. Associations Between Endometriosis and Gut Microbiota. Reprod Sci. 2021;28(8):2367-77. https://doi.org/10.1007/s43032-021-00506-5 26. Jain M, Mladova E, Dobychina A, Kirillova K, Shichanina A, Anokhin D, Scherbakova L, Samokhodskaya L, Panina O. Comparison of microbial profiles and viral status along the vagina-cervix-endometrium continuum of infertile patients. Syst Biol Reprod Med. 2023 Aug;69(4):310-319. https://doi.org/10.1080/19396368.2023.2195040 27. Lu F, Wei J, Zhong Y, Feng Y, Ma B, Xiong Y, et al. Antibiotic Therapy and Vaginal Microbiota Transplantation Reduce Endometriosis Disease Progression in Female Mice via NF-κB Signaling Pathway. Front Med (Lausanne). 2022;9:831115. https://doi.org/10.3389/fmed.2022.831115 28. Martinelli S, Nannini G, Cianchi F, Staderini F, Coratti F, Amedei A. Microbiota Transplant and Gynecological Disorders: The Bridge between Present and Future Treatments. Microorganisms. 2023;11(10):2407. https://doi.org/10.3390/microorganisms11102407 29. MacSharry J, Kovács Z, Xie Y, Adamczyk B, Walsh C, Reidy F, et al. Endometriosis specific vaginal microbiota links to urine and serum N-glycome. Sci Rep. 2024;14(1):25372. https://doi.org/10.1038/s41598-024-76125-2 30. Do H, Diaz-Sylvester P, Groesch K, Wilson T, Delfino K, de Mola JRL, et al. Influence of Hormonal Factors, Number of Sexual Partners, Surgical Intervention on Gastrointestinal and Urogenital Microbiota of Patients Endometriosis. Arch Med Res. 2024;55(8):103112. https://doi.org/10.1016/j.arcmed.2024. |
Enfermería Cuidándote. 2025; 8